 |
|
МЕНЮ
|
Учебное пособие: Кинетика химических и электрохимических процессов7. Определите квантовый выход фотохимического синтеза фосгена СО + С12 = СОС12, если количество поглощенной энергии Q = 2.105 Дж, длина волны l = 510 нм, выход фосгена 8,5 кг. 8. Сосуд вместимостью 100 см3, содержащий смесь водорода с хлором, облучен светом с длиной волны l = 400 нм. Скорость поглощения света равна 11,0.10-7 Дж/с. После одной минуты облучения парциальное давление С12 (Р0 = 205 мм рт. ст.) понизилось на 49 мм рт. ст. (проведено при 0 оС). Каков квантовый выход НС1? 9 Аммиак разлагается ультрафиолетовым светом (l=200 нм) с квантовым выходом g = 0,14. Определите количество лучистой энергии, необходимой для разложения 1 г NH3. 6. СЛОЖНЫЕ РЕАКЦИИ 6.1 Необходимые исходные сведения и основные уравнения Для мономолекулярных обратимых реакций типа А « В дифференциальные формы кинетического уравнения:
При равновесии [В]р/[А]р [B]р = [А]0 - [А]р;(6.4) [В]р где [А], [B] – текущие концентрации веществ А и В; [А]0 – концентрация А при t = 0; k1 и k2 – константы скорости прямой и обратной реакций; [А]р и [B]р – концентрации А и В при равновесии; Кр– константа равновесия. Интегральные формы кинетического уравнения:
При условии, что в момент времени t = 0 [B]0 = 0:
Для мономолекулярных параллельных реакций типа С ¬ А ® В дифференциальные формы кинетического уравнения:
Интегральные формы кинетического уравнения:
где k1 и k2 – константы скорости первой и второй реакций. Константы скоростей отдельных стадий для реакций данного типа определяют по соотношению: х1/х2 = k1/k2, (6.12) где х1 и х2 – количества молей веществ В и С, образовавшихся к моменту времени t или приращение концентраций веществ В и С. Текущая концентрация исходного вещества имеет вид [А] = [А]0 – х. (6.12а) Для мономолекулярных последовательных реакций типа
Интегральные формы кинетического уравнения:
[C] = [А]0 - [А] - [B], (6.23) где [А], [В], [С] – текущие концентрации веществ А, В, С; [А]0 – концентрация вещества А при t = 0; k1 и k2 – константы скорости первой и второй реакций: [А] = [А]0 – х; [В] = x – y; [C] = y. Точка максимума на кривой [В] = f(t) характеризуется уравнениями
где tmax – время соответствующее максимальной концентрации вещества В. 6.2 Задачи с решениями 1. Для обратимой
реакции первого порядка Кр = 8, а k1 = 0,4 c-1. Вычислите время, при котором концентрации веществ А и В станут равными, если начальная концентрация вещества В равна 0. Решение. Из константы равновесия находим константу скорости обратной реакции: k-1 = k1/К = 0,4/8 = 0,05 с-1. По условию мы должны найти время, за которое прореагирует ровно половина вещества А. Для этого надо подставить значение х(t) = а/2 в решение кинетического уравнения для обратимых реакций: t Ответ: t = 1,84 с. 2. В параллельных реакциях первого порядка С ¬ А ® В выход вещества В равен 63%, а время превращения а на 1/3 равно 7 мин. Найдите k1 и k2. Решение. Кинетическое
уравнение для разложения вещества в параллельных реакциях имеет вид уравнения
первого порядка
Выход вещества В равен 63%, а вещества D – 37%. Отношение этих выходов равно отношению конечных концентраций веществ В и D, следовательно оно равно отношению соответствующих констант скоростей
Ответ: k1 = 0,037 мин-1, k2 = 0,021 мин-1. 3. В системе протекают две параллельные реакции А + 2В→ → продукты (k1) и A +2C → продукты (k2). Отношение k1/ k2 = 5. Начальные концентрации веществ В и С одинаковы. К моменту времени t прореагировало 50% вещества В. Какая часть вещества С прореагировала к этому моменту? Решение. Запишем
кинетические уравнения для первой и второй реакций: 4. Реакция
разложения изопропилового спирта протекает в присутствии катализатора триоксида
ванадия при 588 К с образованием ацетона, пропилена и пропана. Концентрации
веществ реакции, измеренные через 4,3 с после начала опыта, следующие, ммоль: с Решение: Определим начальное количество С3Н7ОН: [А]0 = с1 + с2 + с3 + с4 = 24,7 + 7,5 + 8,1 + 1,7 = 44,7 ммоль/л. Вычислим сумму констант скоростей реакций:
Определим константу скорости каждой реакции:
Так как х2/х3
= k2/k3, то
Ответ: 5. Последовательная
реакция первого порядка протекает по схеме
Обозначим концентрацию А
при tmax через [А]max. Тогда [А]max = [А] [В] Рассчитаем концентрацию продукта [В] через 69 ч: [В] = = [А]0 - [Р] - [А] = = 1 – 0,061 – 0,001 = 0,938 моль/л. Вычислим время tинд, за которое устанавливается концентрация В, равная 0,01 моль/л, по уравнению [В] = [А]0 Уравнение (1) решаем относительно tинд методом подбора на основании экспериментальных данных:
Принимаем tинд = 2 ч. Точку перегиба кривой [В] = f(t) находим, используя условие 6.3 Задачи для самостоятельного решения 1. Для обратимой реакции
первого порядка 2. Превращение роданида аммония NH4SCN в тиомочевину (NH2)2CS ─ обратимая реакция первого порядка. Рассчитайте скорости прямой и обратной реакций, используя следующие экспериментальные данные:
3. В параллельных реакциях первого порядка: В ¬ А ® С выход вещества В равен 53%, а время превращения А на 1/3 равно 40 с. Найдите k1 и k2. 4. Реакция разложения вещества А может протекать парал-лельно по трем направлениям: D ¬ А ® В î® C. Концентрации продуктов в смеси через 5 мин после начала реакции составляли, моль/л: [В]=3,2, [С]=1,8, [D]=4,0. Опреде-лите константы скорости k1…k3, если период полураспада ве-щества А равен 10 мин. 5. Реакция разложения вещества А может протекать по трем направлениям:D ¬ А ® В î® C. Концентрации продуктов в смеси через 10 мин после начала реакции составляли, моль/л: [В]=1,6, [С]=3,6, [D]=7,8. Опреде-лите константы скорости k1…k3, если период полураспада ве-щества А равен 8 мин. 6. Образец радиоактивного урана массой 100 г распадается по схеме: 239U ® 239Np ® 239Pu. (периоды полураспада – 20 и 600 мин). Рассчитайте массы нептуния и плутония: через 20 мин и 20 суток после начала распада. Определите максимальную массу нептуния, которая может быть получена из данного образца урана. 7. Кинетика обратимой реакции А ↔ В измерена при двух значениях температуры. Получены следующие эксперимен-тальные данные: 1) Т = 293 К
2) Т = 313 К.
Рассчитайте; а) энергии активации прямой и обратной реакций; б) константы равновесия при двух значениях температуры; в) тепловой эффект прямой реакции. 8. В системе протекают две параллельные реакции: А + В → → продукты (k1) и А + С → продукты (k2). Отношение k1/k2 = 7. Начальные концентрации веществ В и С одинаковы. К моменту времени t прореагировало 50% вещества В. Какая часть вещества С прореагировало к этому моменту? 9. Константа реакции цис-, трансизомеризации бутена-2 при 417 оС равна 8,52.10-7 с-1, Константа равновесия при этой температуре равна 1,14. В начальный момент времени присутствует только цисизомер. Определите время, за которое прореагирует 30% бутена-2. 10. Константа скорости прямой реакции NH4SCN ↔ ↔ (NH2)2CS при 25 оС равна 7,66.10-7 мин-1. Константа равновесия при этой температуре равна 1,30. В начальный момент времени присутствует только роданид аммония. Определите время, за которое прореагирует 40% исходного вещества. 11. При смешении (273 К) раствор содержал 73,2% этилового спирта, 0,677 моль HCOOH и 0,0261% HCl (вода не учитывается). Для исследования кинетики реакции образования формиата при 521 К отбирали в различное время пробы объемом 5 мл и оттитровывали Ba(OH)2. Результаты титрования представлены в таблице:
Вычислите константы образования k1 и разложения k2 этилформиата в этом растворе и константу равновесия обратимой реакции Кр, если концентрации воды, этанола и ионов водорода постоянны. 12. Образование этилового эфира муравьиной кислоты при 303 К протекает по уравнению реакции первого порядка: HCOOH + C2H6O → HCOOC2H5. Были получены следующие результаты:
Концентрацию кислоты определяли титрованием. Константа обратной реакции k1 = 1,5.10-5 мин-1. Концентрация продукта прямой реакции в начальный момент равна 0. Определите константу прямой реакции. 13. Для реакции между иодистым метилом и раствором диметилпаратолуидина в нитробензоле CH3C6H4N(CH3)2+CH3I® ® H4C6H3CN(CH3)3 получены следующие данные:
Константа равновесия реакции равна 69,8. Начальные концентрации обоих реагентов равны 0,05 моль/л, продукт в процессе реакции отводится. Определите, по какому кинетическому уравнению следует описать кинетическую кривую, и рассчитайте константу скорости реакции. 14. Реакция термического крекинга нефти относится к консекутивной реакции, причем бензин является промежуточным продуктом, распадающимся на газообразные вещества. Определите максимальную концентрацию бензина и время ее достижения при крекинге 1 т нефти, если при 673 К константа образования бензина k1 = 0,283 ч-1, а константа распада бензина k2 = 0,102 ч-1. 15. Покажите, что для
реакций А 16. Определите периоды
полураспада RaB и RaC, связанные генетическим рядом: RaB
17. Для последовательной реакции первого порядка А 18. Для последовательной
реакции первого порядка: А 19. Для последовательной
реакции первого порядка: А ОТВЕТЫ К ЗАДАЧАМ Тема 1 1. 0,055. 2. 6.10-3
моль/л. 3. I
= 0,006; aCa2+ = 6,4.10-3
моль/л; aCl- = а Тема 2 1. -126 В. 2. -2,39 В; -2,42 В; -2,45 В. 3. -0,28 В. 4. 0,1 моль/л. 5. 7,6. 6. 1,8.106. 7. 6,5.10-13. 8. -0,4141 В. 9. ΔG = = -4,400 кДж/моль; DH = 5,348 кДж/моль; ΔS = 32,8 Дж/(моль.К). 10. 0,4910 В. 11. 109,99 кДж/моль. 12. -94,25 кДж/моль. 13. Е = 0,968 В; (dE/dT)p = 1/85.10-4 В/К. 14. 0,1287 В. 15. 0,12 В. Тема 3 1. 0,21 л/с и 0,15 л/с. 2. 0,0045 моль/(л.с); 0.0023 моль/(л.с). 3. 0,15 с-1; 4. 144 мин.; 5. 49 лет. 6. 120 суток. 7. 0,091 мг.; 0,003 мг. 8. 0,018 моль/(л.с); 25 с. 9. 0,043 л.с/моль; 45 мин; 34 мин. 10. 2. 11. 1; 0,0095 с-1. 12. 29,4 ч.; 13. 11,6 лет. 14. 2; 0,0012 моль/(л.с). 15. 0,0037 моль/(л.с); 320 с. 16. 38 мин. 17. 34 мин. 18. 1; 0,018 с-1. 19. 2. 20. 0,0075 моль/л. Тема 4 1. 70,1 кДж/моль; 0,02264 с-1. 2. 0,58 сек. 3. 3,69.10-17; 4,2.1024. 4. 314,9 кДж/моль; 4,2.1024. 5. 1210 сек. 6. В 10 раз. 7. В два раза. 8. В 43 раза. 9. На 67 0С. 10. 2,6. 11 На 18 0С. 12. При 110 0С. 13. 13,57 мин. 14. 39 0С. 15. 1,9. 16. 85 кДж/моль; 920 кДж/моль. 17. 47 ч. 18. 0,0002. 19. 350 К. 20. 288 К. Тема 5 1. Е = 663,5 кДж/моль.2. γ = 2,1. 3. λ = 0,5.10-6м. 4. 2,5.10 Дж/(моль.с). 5. γ = 4,8.105. 6. γ = 16,6. 8. γ = 100. 9. 251 кДж. Тема 6 1. 3,36 ч. 2. w1 = 0,22 моль/(л.c); w2 = 0,003 моль/(л.c). 3. k1=0,01 c-1; k=0,05 c-1. 4. k1=0,004 c-1; k2= 0,0023 c-1; k3=0,002 c-1. 5. k1=0,024 c-1; k2= 0,021 c-1; k3=0,019 c-1. 6. 21,5 г; 17,6 г; 1,9 г; 0.7 г. 7. Еа,1,2=126,5 и 212,7 кДж; К1,2 = 0,15 и 1,25; -345,4 кДж/моль. 8. 48,1%. 9. 94 с. 10. 220 мин. 11. k1=0,133 c-1; k2 0,096 c-1; K=47,6; 12. k= 1,35 c-1. 13. По уравнению реакции второго порядка. 14. 1,823 кмоль/м3; 1,6 ч.1 6. t1 = 12,5 мин; t2=15,8 мин. 17. 23,3 моль/л; 138 c. 18. 1) 0,347 моль/л; 52 мин; 2) 0,625 моль/л; 0,127 моль/л. 19. 1) 0,237 моль/л; 35 мин; 2) 0,165 моль/л; 0,118 моль/л. СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ 1. Стромберг А.Г., Лельчук Х.А., Картушинская А.И. Сборник задач по химической кинетике: учеб. пособие для хим. техн. спец. вузов / Под ред. А.Г. Стромберга. М.: Высш. шк., 1985. 192 с. 2. Задачи по физической химии: учеб. пособие / В.В. Еремин, С.И. Каргов, И.А. Успенская, Н.Е. Кузьменко, В.В. Лунин. М.: Экзамен, 2003. 320 с. 3. Киселева Е.В. и др. Сборник примеров и задач по физической химии. М.: Химия, 1984. 455 с. 4. Пономарева И.С. Сборник задач по физической химии. М.: Химия, 1965. 200 с. 5. Баталин Т.И. Сборник примеров и задач по физической химии / Киев. ун-т. Киев, 1960. 546 с. 6. Карапетьянц М.Х. Примеры и задачи по электрохимии. М.: Химия, 1974. 301 с. 7. Сборник вопросов и задач по физической химии для самоконтроля: учеб. пособие для вузов/под ред. С.Ф. Белевского. М.: Высш. шк., 1979. 118 с. 8. Краткий справочник физико-химических величин / под ред. А.А. Равделя и А.М. Пономаревой. Л.: Химия, 1983. 231 с. 11. Зайцев О.С. Химическая кинетика к курсу общей химии. М.: Изд-во Моск. ун-та, 1973. 294 с. 12. Свиридов В.В., Попкович Г.А., Васильева Г.И.. Задачи, вопросы и упражнения по общей и неорганической химии. Минск: Изд-во Белорус. ун-та, 1978. 352 с. |
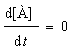 , и если при t = 0 [B] = 0, то
, и если при t = 0 [B] = 0, то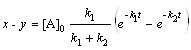 ; (6.19)
; (6.19)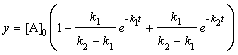 ; (6.20)
; (6.20)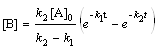 ; (6.22)
; (6.22) ; (6.24)
; (6.24)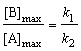 ; (6.25)
; (6.25)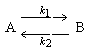
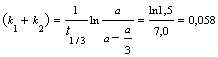 мин-1.
мин-1.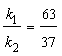 . Решая это уравнение совместно с
предыдущим, находим: k1 = 0,037, k2 = 0,021.
. Решая это уравнение совместно с
предыдущим, находим: k1 = 0,037, k2 = 0,021.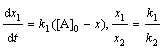 ;
; 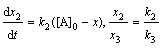 ;
; 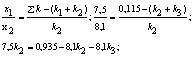
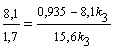 ;
;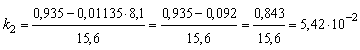 с-1;
с-1;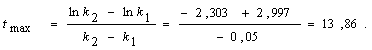
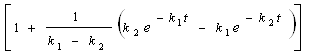 полу-чим точку перегиба:
полу-чим точку перегиба: