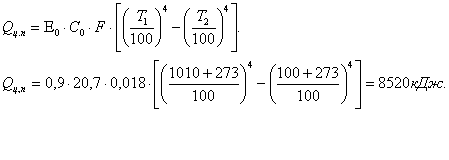|
|
МЕНЮ
|
Дипломная работа: Проектирование отделения вакуумной сепарации титановой губки на базе АО "УК ТМК"Материальный баланс вакуумной сепарации
Таблица 4. Материальный баланс процесса вакуумной сепарации (цикловой)
Исходные данные для расчета. Состав реакционной массы: 4300 кг титана, 2907 кг магния, 682 кг хлорида магния. Температура выдержки в процессе вакуумной сепарации 1010 °С. Аппарат поступающий в отделение сепарации имеет температуру 600 – -650 °С. Температура стенки охлаждаемой оборотной реторты не более 100 °С. Температуры: плавления Mg — 651 °С, кипения Mg — 1102 °С, плавления MgCl2 — 718 °С, кипения MgCl2 — 1410 °С. Тепловой расчет реактора Рассчитываем количество тепла необходимое на испарение магния:
гдеQ/ - скрытая теплота испарения Mg – 5606,5 кДж/кг °С;
С - теплоемкость Mg; G - вес Mg;
Определим количество тепла, необходимого на испарение MgCl2:
гдеQ// - теплота возгонки MgCl2 - 1368 кДж/кг °С;
С - теплоемкость MgCl2 ; G - вес MgCl2 . QMgCl2 = 682 . [0,84 . (718 – 20) + 452 + 1368 + 0,97 . (1010 – 718) = = 1834279 кДж. Определим количество тепла необходимого на нагрев титановой губки: QTi = G . C . (tпл – tг) , гдеС - теплоемкость титана – 0,67 кДж/кг °С G - вес титана - 4300 кг tг - температура губки - 700°С. QTi = 4300 . 0,67(1010 – 700) = 893110 кДж. Количество тепла необходимого на нагрев реактора: Qp = G . C . (tнр – tр), где С - теплоемкость нержавеющей стали – 0,62 кДж/кг °С; G - вес реактора.
гдеdн - наружный диаметр реактора, м; dВн - внутренний диаметр реактора, м;
Qрет = 3310 . 0,62 . (1010 – 600) = 841402 кДж. Расчет потерь тепла в оборотную реторту: - потери через крышку реактора:
гдеE - степень черноты крышки – 0,9; С0 - лучеиспускание абсолютно черного тела 20,7 кДж.
где n - число экранов; F - площадь экранов крышки. Fэ = Fкр – Fц.патр. . Fэ=
- потери через центральный патрубок:
Суммарные потери в оборотную реторту: Qв.обр.рет = Qкр + Qц.п , Qв..обор.рет.= 199805 +8520 =208325 кДж Расчет охлаждения оборотной реторты Расчет охлаждения оборотной реторты производится при конденсации Mg от температуры процесса равной 1010 °С до температуры водоохлаждаемой стенки реторты равной 100 °С. - тепловыделения при конденсации Mg: Q1 = G . Q/, где Q/ - скрытая теплота возгонки Mg - 5606 кДж; G - вес Mg. Q1 = 2907 . 5606 = 16298269 кДж. - тепловыделения при охлаждении магния до температуры плавления 651 °С: Q2 = G × Cж × (tпр – tпл). Q2 = 2907 × 1,4 ×(1010 × 651) = 1458400 кДж. где Cж - теплоемкость Mg = 1,4 кДж. - тепловыделения при затвердении жидкого Mg: Q3 = G × Q// . Q3= 2907 × 362 = 1052087 кДж гдеQ// - скрытая теплота плавления – 362 кДж. - тепловыделения при охлаждении твердого Mg до температуры водо-охлаждаемой стенки реторты: Q4 = G × C × (tпл × tст) . Q4= 2907 × 1,17 × (651 – 100) = 1876490 кДж. где С - теплоемкость Mg в интервале 651 – 100 °С – 1,17 кДж. - Суммарные тепловыделения при конденсации Mg: QMg = Q1 + Q2 + Q3 + Q4 . QMg = 16298269 + 1458400 + 1052087 + 1876490 = 20685248 кДж. Расчет тепловыделений при конденсации паров MgCl2 от температуры процесса 1010 °С до температуры конденсатора 100 °С - тепловыделения от конденсации паров MgCl2: Q1 = G × Q///, где Q/// - скрытая теплота испарения MgCl2 – 1368 кДж. Q1 = 682 × 1368 = 933090 кДж. - тепловыделения при охлаждении от 1010 °С до температуры плавления 718 °С: Q2 = G × Cж × (tпр – tпл) , гдеCж - теплоемкость MgCl2 – 0,97 кДж. Q2 =682 × 0,97 × (1010 – 718) = 193304 кДж. - тепловыделения при затвердевании жидкого MgCl2: Q3 = G × QIÑ . Страницы: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Copyright © 2012 г.
При использовании материалов - ссылка на сайт обязательна.
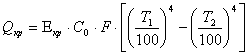 ,
,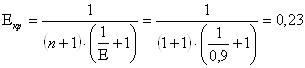 ,
,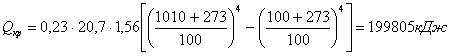 .
.