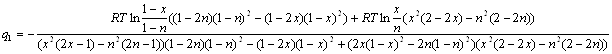|
|
МЕНЮ
|
Курсовая работа: Определение термодинамических активностей компонентов бронзы БрБ2В рамках
данной работы принято считать растворы регулярными во всём диапазоне
концентраций и принимать
Формулы ОТРР позволяют успешно описывать термодинамические свойства металлических, неметаллических и смешанных систем. 2. Расчётная часть Как уже было сказано ранее, бериллиевая бронза БрБ2 содержит в своём составе (по массе) 97,5% Cu, 0,5% Ni, 2% Be. Если условно обозначить медь, как компонент 1, никель, как компонент 2 и бериллий, как компонент 3, то можно для каждого компонента этой тройной системы переписать уравнение (1.3), подставив в него уравнение (1.6) в следующем виде:
Для определения активностей компонентов бронзы при 25°С необходимо установить температурные зависимости энергий смешения Q в низкотемпературном интервале. Для этого можно использовать диаграммы состояния бинарных систем. Для систем Be – Cu и Be – Ni такие зависимости были получены предшествующими исследователями. В данной работе будет выполнен анализ зависимостей для системы Cu – Ni. 2.1 Расчёт зависимости энергий смешения компонентов системы Cu – Ni от температуры Рассмотрим низкотемпературную часть диаграммы Cu – Ni (см. рис. 1.7). Ниже линии солидуса образуется ряд непрерывных твёрдых растворов с решёткой ГЦК. Однако при температурах ниже 342°С наблюдается купол расслаивания на твёрдый раствор на основе меди (обозначим его, как α-фазу) и твёрдый раствор на основе никеля (обозначим его, как γ-фазу). Внутри купола находится смесь этих фаз. На границе купола α-фаза находится в равновесии с γ-фазой. Это можно записать следующими уравнениями:
Для любого из компонентов 1 и 2 и в α- и в γ-фазе справедливо соотношение:
Обе фазы имеют одинаковую структуру (ГЦК). Это можно объяснить высоким сродством меди и никеля. На диаграмме состояния (рис. 1.7) видно, что сплав плавится конгруэнтно во всём диапазоне концентраций. Более того, линии ликвидуса и солидуса расположены очень близко друг к другу, то есть плавление происходит почти в изотермических условиях, как у чистого металла. Аналогично происходит и испарение сплава. На основании этого можно записать, что:
Тогда система (2.4) перепишется в виде:
Обозначим через х мольные доли компонентов в α-фазе, а через N – мольные доли компонентов в γ-фазе, и учитывая условия нормировки их на единицу, можно систему уравнений (2.7) с учётом (1.3) и (1.6) переписать в следующем виде:
Если бы были известны мольные доли x и N при 25°С, то можно было бы с помощью (2.8) непосредственно вычислить значения Q при этой температуре. Однако при столь низкой температуре невозможно получить экспериментальных данных о координатах купола расслаивания. Дело в том, что наступление равновесия между фазами происходит, благодаря диффузии атомов, а в комнатных условиях она протекала бы экстремально долго (несколько сотен лет). Поэтому необходимо изучить температурную зависимость энергий смешения и экстраполировать её на уровень комнатных температур. Если T=const и известны все x и N, то система уравнений (2.8) линейна относительна параметров Q и может быть решена аналитически. Обозначим
Выразим
Подставим (2.10) во второе уравнение системы (2.9):
Теперь
можно выразить в явном виде величину
Теперь приведём выражения в числителе и знаменателе дроби (2.12) к общему знаменателю:
(2.13) Умножив
числитель и знаменатель дроби (2.13) на выражение
(2.14) Система уравнений (2.9) не имеет степеней свободы, поэтому случайная погрешность отсутствует. Возможно, пользуясь законом накопления ошибок, определить систематическую погрешность и рассчитать доверительный интервал для значений Q. В данной работе это не учитывается. Координаты купола расслаивания при различных температурах были сняты с диаграммы состояния Cu – Ni (рис. 1.7) и представлены в таблице 2.1. Табл. 2.1. Координаты купола расслаивания твёрдого раствора при разных температурах.
Для
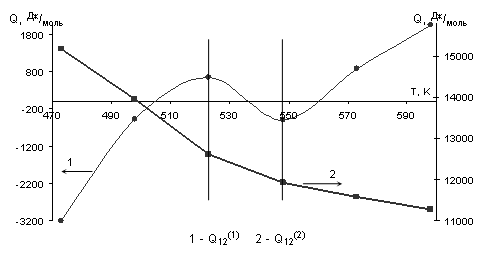
каждой из температур были проведены вычисления значений энергий смешения. Результаты вычислений приведены в таблице 2.2, а график температурной зависимости энергий смешения – на рисунке 2.1. Табл. 2.2. Значения энергий смешения компонентов системы Cu – Ni при разных температурах
Рис. 2.1. Зависимости энергий смешения компонентов системы Cu – Ni от температуры. 2.2 Расчёт купола расслаивания твёрдого раствора Cu–Ni Для проверки адекватности модели, использованной при решении, а следовательно и правильности определения значений энергий смешения необходимо решить обратную задачу – по известным температурным зависимостям величин Q рассчитать координаты купола расслаивания и сравнить его со снятым с диаграммы состояния. Фактически, необходимо решить систему относительно x, N и T. В соответствии с правилом фаз Гиббса, система Cu – Ni имеет одну степень свободы. Это означает, что только один из параметров x, N, T является независимым. Для однозначного решения необходимо задавать один параметр и, решая систему (2.8), находить остальные. Для учёта зависимостей Способ №1. Результаты аппроксимации зависимостей Q=f(T) представлены в таблице 2.3. Там же приведены значения полученных коэффициентов достоверности аппроксимации (квадратов коэффициентов корреляции). Табл. 2.3. Аппроксимация зависимостей Q=f(T).
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Copyright © 2012 г.
При использовании материалов - ссылка на сайт обязательна.
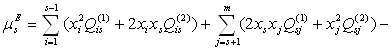
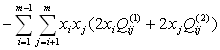 (1.6)
(1.6)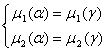 (2.4)
(2.4) (2.7)
(2.7)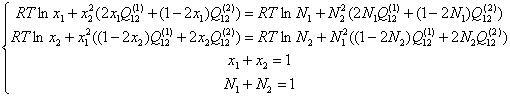 (2.8)
(2.8)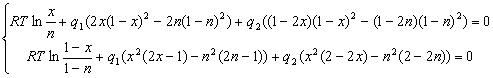 (2.9)
(2.9)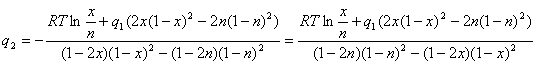 (2.10)
(2.10)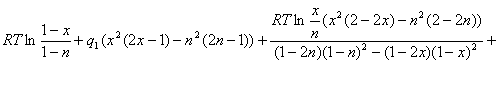
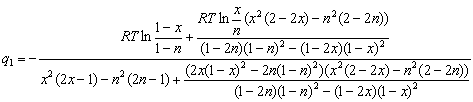 (2.12)
(2.12)